两篇《自然》文章揭示新冠病毒感染能力为何更强
转眼2020年进入第二季度,新型冠状病毒(SARS-CoV-2)导致的COVID-19疫情当下仍在全世界蔓延,确诊病例已近80万,而被感染的人数依然在增加。不得不说,这种新病毒十分狡猾,而我们对其感染特性的了解依旧很有限。
在清华大学和明尼苏达大学两支科研团队的努力下,有两项最新研究日前在顶尖学术期刊《自然》同时在线发表,科学家们从病毒的独特结构着手,对新冠病毒何以具有比SARS病毒更强的传染性做出了进一步解释。
这两篇论文以“加快评审文章”形式上线,为研究人员尽快理解COVID-19的传播特点,以及如何开发疫苗和药物,提供了重要的指导信息。

我们现在已经知道,新冠病毒入侵人体细胞时,其表面的S蛋白起了关键作用。S蛋白通过受体结构域(RBD)与人体细胞上的受体ACE2相结合,这是启动感染的第一步,也是中和抗体及疫苗研发的重要靶点。
在清华大学王新泉教授和张林琦教授联合攻关的研究工作中,科研人员成功获到了新冠病毒RBD与人ACE2结合的复合物晶体,利用X射线衍射技术,得到了高分辨率的晶体结构数据,能够在原子水平清晰地看到新冠病毒RBD与受体如何相互作用。
研究人员准确定位出了新冠病毒RBD与ACE2直接相互作用的氨基酸位点,发现与SARS病毒结合ACE2的模式十分相似,结合同样的ACE2氨基酸残基,两者RBD上仅仅只有几个氨基酸残基的差别。而这些微小的差异,却可以让新冠病毒结合受体能力变得更强。
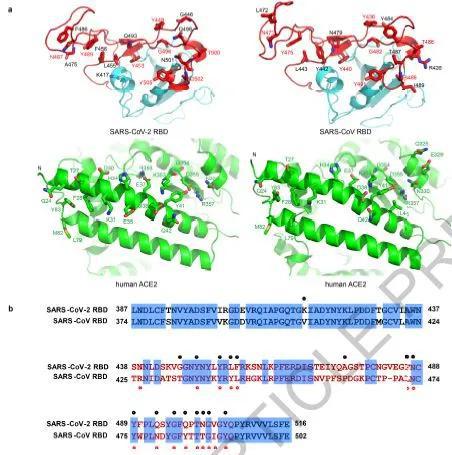
▲将新冠病毒RBD和SARS病毒RBD分别与受体直接相互作用的部位进行对比,分别以黑点与红点标注的关键位点大部分相同或相似(图片来源:参考资料[1])
不过论文中指出,与受体结合力更高,只是新冠病毒传播力更强的原因之一。S蛋白RBD以外的部位,例如特殊的酶切位点,也是新冠病毒快速传播的重要因素。
在这篇论文取得同行评议之前,科研团队在第一时间通过预印本平台bioRxiv分享了他们的结果,其主要结论后续得到了其他研究的佐证。

同时在Nature上线的另一篇论文,由明尼苏达大学的李放教授带领团队完成。研究人员同样根据X射线衍射数据,确定了新冠病毒RBD与人类受体ACE2结合的复合物三维结构,分辨率达到2.68 ?。
通过与SARS病毒的氨基酸序列相比较,研究人员鉴定出了新冠病毒与受体结合力更强的两个结构特征。一方面,新冠病毒与受体接近的部位有更紧凑的构象,和受体形成的接触更多。
更值得注意的是,从过去的经验看,SARS病毒与ACE2相互作用的接触面上,有两个重要的“病毒结合热点”。而观察新冠病毒,他们发现,病毒结合热点附近的几个氨基酸有所不同,这些变化让病毒与受体的结合更加稳固,从而赋予了新冠病毒更强的受体结合亲和力。
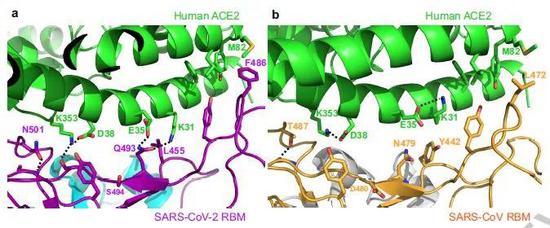
▲在病毒RBD-受体的接触面,病毒结合热点附近的氨基酸有微小却重要的不同(图片来源:参考资料[2])
研究人员还通过实验证明,在序列上与新冠病毒更相似的一种蝙蝠冠状病毒RaTG13,同样可以直接结合人类ACE2受体。这一结果支持了新冠病毒是从动物传到人类中的观点。
随着科学家们对新冠病毒如何结合人类细胞受体有越来越深入、清晰的理解,这些结构学信息有助于科研人员按图索骥寻找和设计药物,阻断病毒感染。“如果有一种新的抗体药物可以结合到新冠病毒的这些受体结合位点上,并且结合得比受体更快、更牢固,那么,抗体药物就可以把病毒挡在细胞外,有望作为一种有效的抗感染疗法。”李放教授说道。
