困在时间里|寻找阿尔茨海默的基因变异拼图
·阿尔茨海默病基因研究先驱鲁道夫·坦齐曾说到,罕见变异在人群中的发生频率低于1%,却占个体基因组变异的77%,仅使用全基因组关联研究(GWAS)可能会错过疾病的大部分遗传景观。

时隔百年,与探究阿尔茨海默病理机制密切相关的两位女性。
逃离阿尔茨海默病的命运
1906年,55岁的奥古斯特·德特女士(Auguste Deter)去世,德国精神病学家阿尔茨海默(Alois Alzheimer)解剖了她已经萎缩的大脑,发现其中渗透有微小的斑块,还有奇怪的缠结标记神经元的死亡,足以将她的疾病与其他的痴呆症区分开来。它们被后世命名为β淀粉样蛋白(Aβ)和tau蛋白,成为阿尔茨海默病的独特标志物。
一百多年后,哥伦比亚安蒂奥基亚的艾丽娅(Aliria Rosa Piedrahita de Villegas)被研究人员称作“我们时代的奥古斯特”。她所在的大家庭拥有一种罕见的遗传性基因突变,几乎可以确保她在40岁左右就会罹患早发性阿尔茨海默病。然而,直到72岁,她才出现轻微的症状。2020年11月,她因黑色素瘤去世,享年77岁,离开前几个月仍记得家人和朋友、自己做饭和洗澡,并且可以毫不费力地记住“神经科学”和“冠状病毒”之类的名词。
艾丽娅究竟如何逃过了被阿尔茨海默病“诅咒”的命运,长久吸引着科学家的目光。此前他们已经通过脑核成像技术发现,她的大脑里含有大量Aβ,却没有多少tau蛋白,在普通患者中,两者往往先后出现和累加。艾丽娅的独特之处在于,她除了具有家族遗传的致病基因突变PSEN1 E280A之外,她还有一个极其罕见的基因突变——APOE3 Christchurch,且是来自父母双方的纯合子(其他人只有来自父母一方的一个基因突变拷贝)。
在APOE的3个等位基因中,APOE4被公认为阿尔茨海默病的最强风险基因,APOE2则是保护基因,而APOE3则没有特别的影响。但艾丽娅的病例显示,基因之间存在相互作用,一种罕见突变可能对抗另一种。
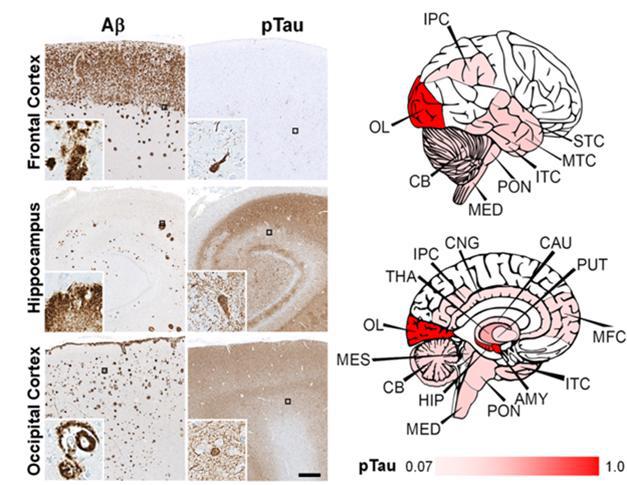
艾丽娅的脑部影像显示,β淀粉样蛋白与tau蛋白似乎“断绝关系”。
艾丽娅给世界留下了一个珍贵的礼物:她的大脑。借助单细胞 RNA 测序,研究人员得以揭示特定基因在脑细胞中的表达方式。最近的研究发现,她的tau蛋白病理发展,在很大程度上“放过”了对判断和其他执行功能很重要的额叶皮质,以及对记忆和学习很重要的海马体,转而涉及了枕叶皮层,即控制视觉感知的头部后部大脑区域。枕叶皮质是唯一表现出典型阿尔茨海默症特征的主要大脑区域,例如称为小胶质细胞的保护性脑细胞的慢性炎症,和降低的APOE表达水平。【1】
还有一种罕见的APOE3变体APOE3-Jacksonville,也可以降低一个人患阿尔茨海默病的风险。自2014年被报道以来,直到去年科学家才揭示它背后的潜在机制是减少APOE的自聚集,这与促进胆固醇排出和增强的脂质结合能力有关,可以降低淀粉样蛋白负荷和相关毒性,促进大脑的修复和健康老化。【2】
“对阿尔茨海默病和认知衰退有抵抗力的患者,正在引领我们对阿尔茨海默病病理生理学理解的一场革命,并为新的、受患者启发的疗法铺平道路。”麻省总医院多文化阿尔茨海默症预防项目(MAPP)主任、哈佛医学院精神病学副教授亚基尔·基罗斯(Yakeel T. Quiroz)参与领导了APOE3 Christchurch的研究。她认为,APOE3-Jacksonville与硫酸乙酰肝素蛋白聚糖的相互作用受损,可能是与认知症风险降低相关的 APOE 变体(包括 APOE3-Christchurch 和 APOE2)的共同特征,需要进一步研究。
进入基因组“暗物质”研究
早期发现的阿尔茨海默病基因,如导致早发性阿尔茨海默病的APP、PSEN1、PSEN2,和晚发性阿尔茨海默病的主要风险基因AOPE,都与加速淀粉样蛋白沉积有关。2008年,阿尔茨海默病基因研究先驱鲁道夫·坦齐(Rudolph Tanzi)的实验室,首次发现与神经炎症相关的阿尔茨海默基因CD33,它携带着小胶质细胞上受体的遗传密码。
小胶质细胞通常充当大脑的管家之一,清除神经碎片,包括斑块和缠结。5年后,坦齐和他的同事们研究发现,CD33影响小胶质细胞的活动:当该基因高度表达时,小胶质细胞会从管家转变为神经元杀手,从而引发神经炎症。此后,与CD33具有相反作用的另一个阿尔茨海默基因TREM2也被发现,它可以关闭小胶质细胞促进神经炎症的能力。
这或许能够与部分特殊病例相印证:他们在尸检中被发现脑部有大量淀粉样斑块和神经元纤维缠结,却始终没有出现阿尔茨海默病症状,原因就在于他们没有神经炎症。用坦齐的比喻来说,感染点燃了淀粉样蛋白病变的火柴,随着蛋白积累,杀死神经元,引发神经炎症,随后才蔓延为脑内的“丛林大火”。
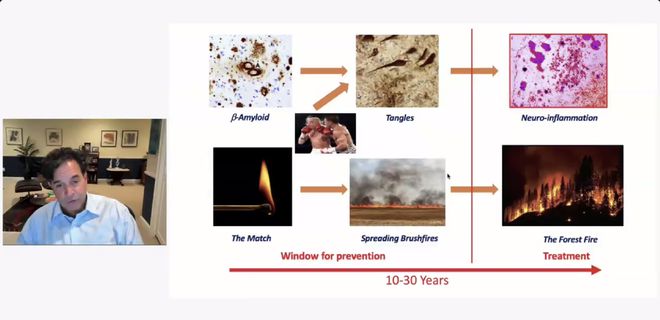
鲁道夫·坦齐在线上演讲中,介绍神经炎症在阿尔茨海默发病机制中的重要性。
今年4月,一项迄今为止最大规模、涉及10万患者和60万健康人的全基因组关联研究结果出炉。在识别出的75个与阿尔茨海默有关的基因组区域中,新发现了42种阿尔茨海默基因,同样将阿尔茨海默病与大脑免疫系统受损联系了起来。【3】
“创建一个广泛的阿尔茨海默病风险基因列表,就像一个大型拼图过程,这项工作虽然没有为我们提供完整的画面,但给出了宝贵的框架。当然,它也告诉我们阿尔茨海默症有多么复杂,多种不同机制影响着疾病发展。”英国阿尔茨海默症研究中心的研究主任苏珊·科尔哈斯(Susan Kohlhaas)说道。
不过,仅仅有全基因组关联研究(GWAS)或许仍然不够。阿尔茨海默病的遗传力(即遗传变异占表现型总变异的百分数)估计在60%-80%之间。“APOE,APP,PSEN1和PSEN2,加上前40个GWAS基因,仅占阿尔茨海默病遗传风险的一半,剩下的另一半未知,这是我们进入基因组‘暗物质’的地方——罕见变异。”坦齐曾说到,罕见变异在人群中的发生频率低于1%,却占个体基因组变异的77%。【4】
去年4月,坦齐和同事们利用全基因组测序(WGS),发表了新发现的13 个与阿尔茨海默病有关的罕见变异基因。它们可以提供阿尔茨海默病与神经发育、突触功能(传递化学和电通讯信号的脑细胞之间的连接)和神经可塑性(神经元重组神经元的能力)之间的一些最初的遗传联系。【5】“我们相信我们已经创建了一个新模板,用于超越标准 WGS以及疾病与常见基因组变异的关联,其中你错过了疾病的大部分遗传景观。”
麻烦的是,罕见突变可能只发生在一个人或一个家庭中。 “在阿尔茨海默病测序项目中进行全基因组测序的2万人中,54% 的单核苷酸多态性仅在一个人身上看到,”斯坦福大学博士扬·勒·根(Yann Le Guen)说。如此小的样本量要如何确定与阿尔茨海默病的关联?功能多组学分析是关键策略。
罕见基因变异堪称基因组中的“暗物质”。
罕见基因变异能告诉我们什么
寻找阿尔茨海默罕见功能基因变异的研究通常分为三类:一是在已知关联基因中寻找罕见功能变异,例如错义突变、插入/缺失、剪接变体、移码和早期终止密码子等;二是系统运用全基因组测序 (WGS) 和基于全外显子组测序 (WES) 数据,来识别罕见的功能变异;三是在新的假设驱动阿尔茨海默病的候选基因中,寻找罕见功能基因变异。一些罕见的基因变异簇还可以识别疾病相关的新基因,或表明已知疾病相关蛋白的哪个域可能出现故障。
今年4月,俄亥俄州克利夫兰凯斯西储大学的研究团队,从大约5500个阿尔茨海默病例和 5000个阿尔茨海默测序项目(ADSP)对照的WES数据着手,在近21000个基因中识别出超过160万个罕见变异。再将这些变异映射到蛋白质数据库中的6000多种蛋白质结构,以及人工智能 AlphaFold 推定的近 17500 个蛋白质结构上,发现只有少数相应基因具有统计显著性的罕见基因变异簇。
随后再在一个ADSP WES独立队列中搜索这些基因变异热点,最后锁定了三个基因:除了已知的TREM2和 SORL1,还有一个全新的基因EXOC3L4。它表达一种过去知之甚少的蛋白质,预计是外囊复合物的一个组成部分,参与囊泡运输和胞吐作用。
在这项研究的分析中,这三个基因的突变数分别达到33、56和68个。在阿尔茨海默病例中,有15个EXOC3L4变体落入 C 端 Sec6 域。【6】此前研究显示,该领域内的罕见变异与阿尔茨海默病的皮质葡萄糖代谢有关。
“这项研究提出的评估罕见错义变异同时考虑其在蛋白质中的空间分布的统计方法,在阿尔茨海默病研究领域是新颖的,特别有助于聚合在空间上聚集在一起的单例。”扬·勒·根评价,这为未来的药物开发提供了信息,即应该针对蛋白质的哪个结构域会对疾病产生影响。
“目前大约有100种阿尔茨海默相关的基因变异已经被确认,其中大约一半是保护性的,一半是危险因素,其中大多数还没有被确认的功能。”坦齐认为,接下来的问题是如何评估个体的风险,许多团队正在开发多基因风险评分,“一个好的多基因风险评分,不依赖于单个基因和基因功能,而是基于基因组单个片段的遗传模式。”
“识别已确立和新的候选阿尔茨海默基因中的罕见功能变异,有望加速阿尔茨海默病遗传数据转化为有意义的生物学数据,并更好地理解阿尔茨海默病,以及如何治疗这种毁灭性的疾病。”坦齐说。
