1篇Science成功转化为1家新公司,融资已达2亿美元
目前,人类基因治疗所使用的递送载体,主要有慢病毒、腺病毒、腺相关病毒(AAV),以及脂质纳米颗粒(LNP)等,但这些递送载体有的会随机整合到基因组中,有的效率低下,有的会导致不必要的免疫反应。
整个生物医学界都在努力开发新的更强的分子疗法,但将这些疗法精确有效地递送到细胞中却充满挑战。如今,张锋为这些挑战带来了一种全新的答案,试图解决基因编辑/基因治疗面临的最大问题——递送。
日前,据美国科技媒体 Business Insider 报道,张锋创立了一家名为 Aera Therapeutics 的新公司,这也是张锋创立的第7家生物技术公司。此前,张锋已经参与创立了 Editas、Beam、Pairwise、Sherlock、arbor、Proof Diagnostics,涵盖了 CRISPR-Cas9基因编辑疗法开发、碱基编辑疗法开发、基于CRISPR的农业育种、基于CRISPR的诊断,以及新型基因编辑工具的开发等方向。
目前 Aera Therapeutics 已完成由 Arch 和 Google Ventures 提供的2亿美元融资,目前该公司还处于隐身模式,更多信息仍不得而知。但该公司基于张锋实验室一年前发表的一篇 Science 论文,接下来,我们将通过这篇论文来了解张锋这一新公司的底层技术及其发展方向。

2021年8月19日,张锋团队在国际顶尖学术期刊 Science 发表了题为:Mammalian retrovirus-like protein PEG10 packages its own mRNA and can be pseudotyped for mRNA delivery 的研究论文【1】。
研究团队开发了一种全新的RNA递送平台——SEND(Selective Endogenous eNcapsidation for cellular Delivery),SEND的核心是逆转录病毒样蛋白PEG10,它能够与自身的mRNA结合并在其周围形成球型保护囊。研究团队将其改造设计后用来包装和递送RNA。
研究团队使用SEND系统将CRISPR-Cas9基因编辑系统递送到小鼠和人类细胞并成功编辑了目标基因。这将为基因治疗提供一种全新的递送载体,SEND系统是利用人类内的组分自组装为病毒样颗粒,与其他递送载体相比,所引起的免疫反应更少,更具安全性。
张锋表示,SEND 技术可以补充现有的病毒递送载体和脂质纳米颗粒,以扩展向细胞递送基因和编辑疗法的工具箱。

灵感源自逆转录转座子
在整个进化过程中,逆转录病毒和逆转录元件已将其遗传密码插入哺乳动物基因组中。尽管这些整合的病毒样序列中的许多对宿主基因组完整性构成威胁,但有些已被哺乳动物细胞重组以在发育中发挥重要作用。其中,人类基因组中有大约8%是在远古时代感染人类的逆转录病毒的残余。
PEG10蛋白天然存在于人类中,源自“逆转录转座子”——一种类似病毒的遗传元件,它们在数百万年前就将自身整合到人类祖先的基因组中。随着时间的推移,PEG10已被人类身体吸收,成为对生命很重要的蛋白质库的一部分。
2018年1月,犹他大学的 Jason Shepherd 实验室在 Cell 发表论文【2】,该研究发现了一种逆转录转座子来源的蛋白ARC能够形成病毒样结构,并参与细胞间RNA的转移。

这项研究表明有可能将逆转录转座子蛋白设计为一种递送平台,但当时尚未成功利用这些蛋白质在哺乳动物细胞中包装和递送特定的RNA。
值得一提的是,Jason Shepherd 基于这项研究创立的公司 VNV 已被 Aera Therapeutics 收购,Jason Shepherd 也出任了 Aera 的科学顾问。
为了探索逆转录转座子作为基因递送平台的潜力,张锋团队开始系统搜索人类基因组中的这一类蛋白质,寻找可以形成保护囊的蛋白质。初步分析后,张锋团队发现人类基因中有48个基因编码的蛋白质可能具有这种能力,其中19个同时存在于小鼠和人类中。
在体外细胞实验中,张锋团队发现,这些蛋白质中,潜力最突出的是PEG10,细胞能够释放出PEG10颗粒,而且这些PEG10颗粒也大多含有它们自己的mRNA,这表明PEG10可能能够包装特定的RNA分子。
开发递送平台
为了将PEG10开发为递送平台,张锋团队对PEG10进行了改造,首先,他们在PEG10的mRNA序列中找到了识别和包装其RNA的序列,然后对PEG10蛋白和该mRNA序列进行改造,以便PEG10能够选择性包装RNA。然后研究团队用融合蛋白修饰PEG10蛋白,以促进其与细胞膜的融合,帮助其更好地进入细胞。
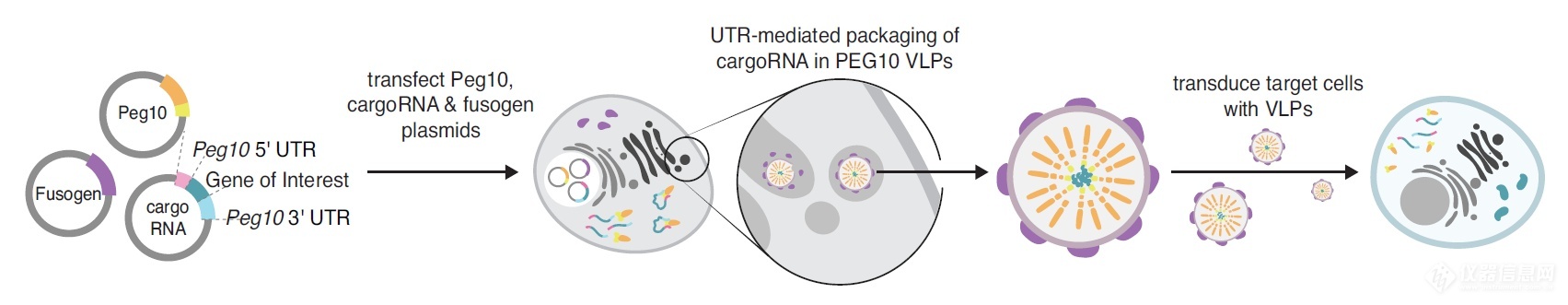
通过这一系列的改造,PEG10有望靶向特定种类的细胞、组织或器官,并进行RNA递送。

推进基因治疗
SEND系统由人体内自然产生的蛋白质组成,这意味着它可能不会触发免疫反应。如果后续进一步研究证实了这一点,那么SEND将有望成为具有最小副作用的可重复使用基因治疗递送载体。
张锋团队使用SEND成功将CRISPR-Cas9系统以mRNA形式成功递送至人类和小鼠细胞中,并编辑了特定基因。接下来,张锋团队还将在动物中进一步测试SEND,并对其进行进一步改造设计,使该系统能够向各个组织和细胞中递送mRNA。
张锋表示,这项研究表明,可以利用PEG10以及人体中其他类似蛋白质来设计新的递送载体,并开发出新的基因疗法。
这一全新递送平台SEND能够在细胞模型中有效工作,并且随着进一步发展,可以为广泛的分子药物开辟一类新的递送方法——包括用于基因编辑和基因替换。SEND技术也将补充病毒递送载体和脂质纳米颗粒,以进一步扩展向细胞递送基因和编辑疗法的工具箱。
论文链接:
1.https://science.sciencemag.org/content/373/6557/882
2.https://doi.org/10.1016/j.cell.2017.12.024
