“软”CRISPR可能为遗传缺陷提供新的修复方法
现在,一个生物学家团队开发了一种更安全的新方法,它可能在未来纠正基因缺陷。他们的策略利用了天然的DNA修复机制并为新型的基因治疗策略提供了一个基础,其有可能治愈大量的遗传性疾病。该研究于7月1日发表在《Science Advances》杂志上,由加州大学圣地亚哥分校(UCSD)的一个生物学家团队展开,其中包括博士后学者Sitara Roy、专家Annabel Guichard和Ethan Bier教授。
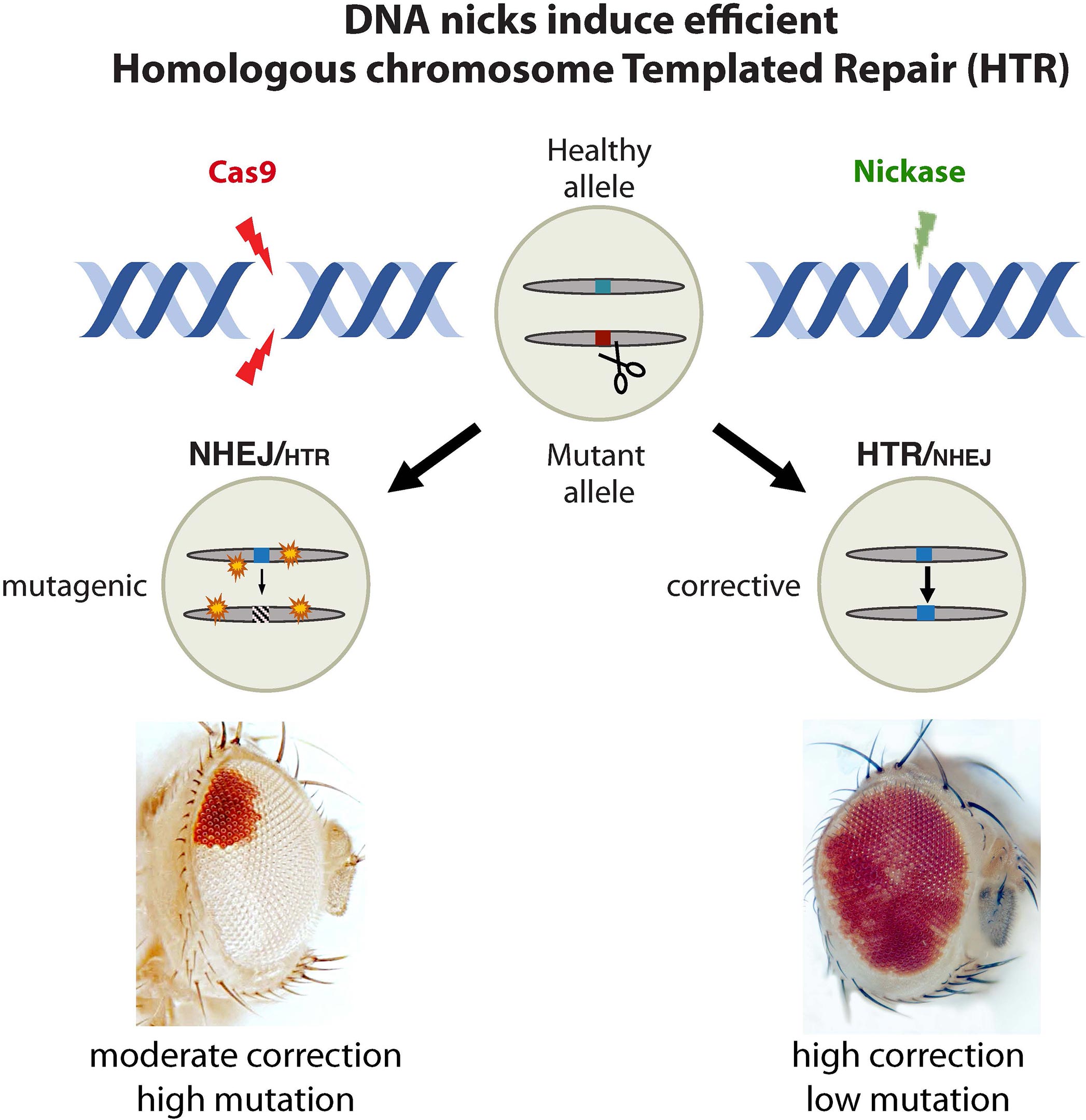
那些患有遗传性疾病的人往往在从父母那里继承的两份基因中携带不同的突变。这意味着在许多情况下,一条染色体上的突变会在另一条染色体上有一个功能序列对应。科学家们使用CRISPR基因编辑工具来利用这一事实。
该研究的论文第一作者Guichard说道:“健康的变体可以被细胞的修复机制用来在切割突变的DNA后纠正有缺陷的突变,值得注意的是,这可以通过一个简单的无害缺口更有效地实现。”
科学家们在果蝇中设计了突变体,通过它们眼睛中色素的产生允许可视化这种“同源染色体修复(HTR)”。这种突变体最初的特点是眼睛完全是白色的。但当同样的苍蝇表达CRISPR组件(一种引导RNA加Cas9)时,它们的眼睛上显示出大面积的红色斑块,这表明细胞的DNA修复机制已经成功地利用另一条染色体的功能性DNA逆转了突变。
然后,研究人员用被称为“缺口酶”的Cas9变体测试了他们的新系统,该变体只针对DNA的一条链而不是两条链。令人惊讶的是,研究人员们发现这种缺口也能使红眼颜色得到高水平的恢复,几乎跟正常(非突变)的健康苍蝇一样。他们发现缺口酶的修复成功率为50-70%,而双链切割Cas9的修复成功率仅为20-30%,后者也会产生频繁的突变并针对整个基因组的其他位点。
研究论文第一作者Roy表示:“我无法相信缺口酶的效果有多好,这完全是意料之外的。研究人员指出,这个新系统的多功能性可以作为修复哺乳动物基因突变的模型。”
Guichard则指出:“我们还不知道这个过程将如何转化为人类细胞以及我们是否可以将其应用于任何基因。可能需要进行一些调整,才能获得人类染色体携带的致病突变的高效HTR。”
这项新研究扩展了该小组以前在用“等位基因驱动”进行精确编辑方面取得的成就。“等位基因驱动”扩展了基因驱动的原理,用一种引导RNA来指导CRISPR系统切割基因的不希望的变体并用该基因的首选版本来取代它们。
该小组研究的一个关键特征是,他们基于缺口酶的系统导致的靶上和靶外突变要少得多,而更多传统的基于Cas9的CRISPR编辑是已知的。他们还称,在几天内缓慢、持续地提供缺口酶成分可能比一次性提供更有利。
Bier说道:“这种方法的另一个显著优势是其简单性。它所依赖的成分非常少,而且DNA断裂是‘软’的,不像Cas9那样产生完整的DNA断裂,往往伴随着突变。”
“如果可以通过促进组间配对或优化缺口特异性修复过程来增加这种事件的频率,那么可以利用这种策略来纠正许多显性或反杂合的致病突变,”Roy说道。
