研究:细胞分裂的遗传限制或是老年人感染新冠后死亡的原因
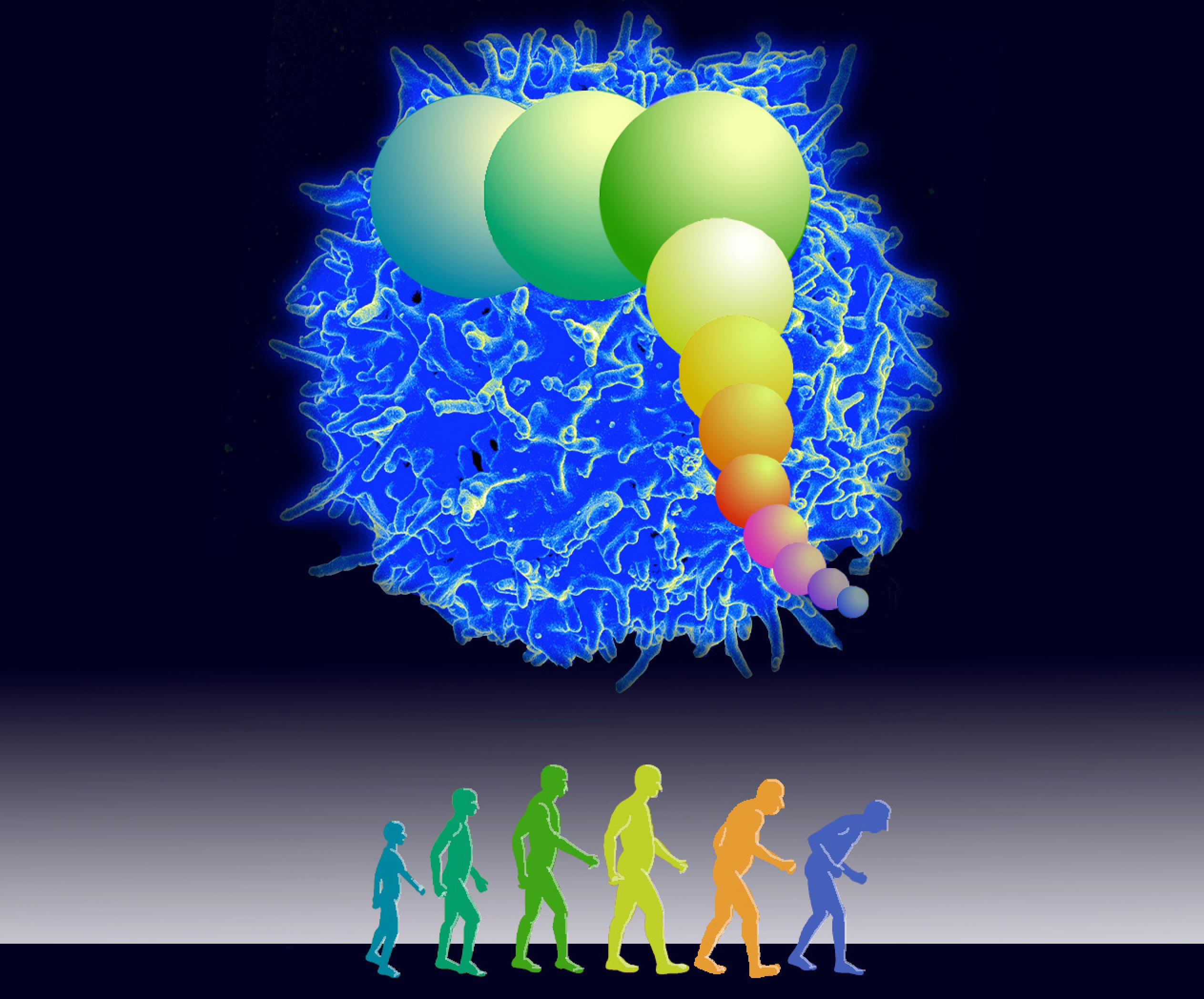
根据UW研究教授James Anderson创建的一个新模型,这种对人体免疫系统的遗传预定限制可能是COVID-19对老年人产生如此破坏性影响的关键所在。Anderson是今年3月31日发表在《柳叶刀eBioMedicine》上的一篇论文的第一作者,该论文详细介绍了衰老、COVID-19和死亡率之间的这种模型联系。
Anderson指出,当DNA在细胞分裂中分裂时,端粒会随着每次分裂而变短一点,“在一个细胞经过一系列的复制之后,它变得太短并停止进一步分裂。并非所有的细胞或所有的动物都有这种限制,但人类的免疫细胞有这种细胞寿命”。据悉,Anderson是水产和渔业科学学院(School of Aquatic and Fishery Sciences)的生物系统建模师。
尽管有这个极限,普通人的免疫系统还是很好地维持着,直到大约50岁。Anderson表示,这时有足够多的核心免疫细胞即T细胞已经缩短了端粒,其无法通过细胞分裂来快速克隆自己进而以足够大的数量来攻击和清除COVID-19病毒--该病毒具有急剧减少免疫细胞数量的特征。另外,Anderson补充称,重要的是,端粒的长度是由从父母那里继承来的。因此,每个年龄段的人之间的这些长度有一些差异。
Anderson指出,这种对衰老的理解--即对免疫系统何时用完集体端粒长度有一个阈值--跟所有人随着时间的推移不断衰老的想法之间的关键区别是他研究中最令人兴奋的发现。
为了建立这个模型,研究人员使用了来自美疾病控制中心和美国人口普查局的关于COVID-19死亡率的公开数据以及关于端粒的研究。
Anderson表示,汇集关于一个人或特定人群的端粒长度信息可以帮助医生知道谁不那么容易受影响。然后他们可以根据哪些人群和个人可能更容易受到COVID-19的影响来分配资源如加强针。
Anderson称:“我是一个建模者,通过数学方程看问题,我通过跟生物学家合作来解释,但生物学家需要通过模型看信息来指导他们的研究问题。一个建模者的梦想是能真正影响伟大的生物学家从而让他们像建模者一样思考。不过这比较困难。”
此外,Anderson对这个模型还发出了一个警告:“大量的数据支持模型的每一个参数,且有一个有关你如何从数据道模型的很好逻辑思路。但它是如此简单、如此直观地吸引人,以至于我们也应该对它保持怀疑态度。作为一个科学家,我希望我们开始进一步了解作为自然选择一部分的免疫系统和群体反应。”
