科研人员在分子笼的协助下揭示癌症蛋白质近原子水平的细节
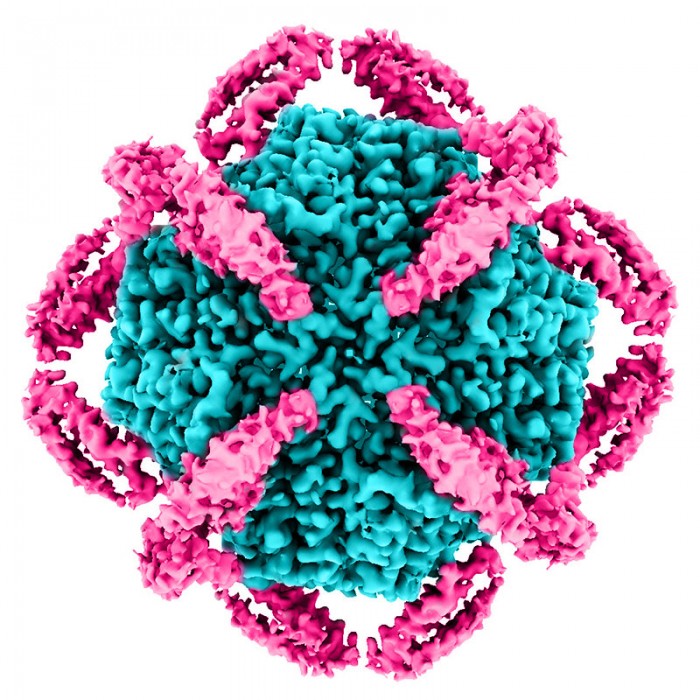
KIX蛋白的详细低温电镜重建(洋红色),围绕着中心的阿波菲林壳(青色)。MBP的外壳没有显示。资料来源:Greg Stewart/SLAC国家加速器实验室
斯坦福大学医学院的教授Kathleen Sakamoto一直致力于开发治疗急性髓细胞白血病和其他血液疾病的药物,试图解决这种情况。然而,她的团队在寻找治疗急性髓细胞白血病的新方法时,由于用于了解蛋白质结构和功能的两种技术之间的微妙差距而受到阻碍--一方面是X射线晶体学,另一方面是低温电子显微镜(cryo-EM)。

夹在MBP外壳(紫色)和apoferritin内壳(蓝色)之间的KIX(红色)的低温电镜重建图。夹层技术帮助研究人员获得了KIX的最佳外观,它是治疗急性骨髓性白血病的潜在目标。
来自斯坦福大学医学院和工程学院以及能源部SLAC国家加速器实验室的研究人员发现了一种缩小这一差距的方法,即使用分子笼来稳定某些中等大小的蛋白质,使它们能够首次用低温电镜进行成像,这可以揭示几乎原子级的细节。第一作者Kaiming Zhang是斯坦福大学的一名博士后研究员,Naoki Horikoshi是一名客座助理教授,在研究时,他和他的同事最近在ACS中央科学杂志上发表了他们的结果。
SLAC和斯坦福大学教授Soichi Wakatsuki说,问题在于KIX,它是CREB结合蛋白(CBP)的一部分,AML癌细胞用它来转录对生长和生存重要的基因。如果研究人员更好地了解它的结构,他们可以设计出抑制KIX的药物,防止癌细胞复制。但使用X射线晶体学研究该蛋白的努力还没有成功。按照晶体学的标准,该分子的尺寸相对较大,使其更难结晶,而且即使它被结晶了,这一过程的特殊性也使其更难分析药物设计者希望瞄准的KIX部分。
同时,KIX本身有点太小,无法用低温电镜进行有效的研究。Wakatsuki解释说,为了用低温电镜获得一个蛋白质的良好图像,必须能够在电子显微镜图像中找到该蛋白质的许多副本,然后弄清楚它们的方向--它们是否以这种或那种方式弯曲,等等。只有通过寻找和排列一个蛋白质的许多图像,冷冻电镜方法才能产生高分辨率的结构。KIX的尺寸相对较小--以冷冻电镜的标准来看--使之成为一项挑战。另一个选择,核磁共振,已经被用来确定KIX与其他自然发生的分子结合时的结构,但该方法需要大量的准备和分析--使得它不太适合快速确定分子的结构,因此也不太适合研究潜在KIX抑制药物的效果。
研究人员是在吃午饭时想到的这种解决方案,当时他们正在进行一个单独的项目。他们将成批的KIX蛋白夹在一个中心的球状分子和一个外部分子笼之间。因为这个"双壳"比单个KIX分子大得多,它将更容易在低温电镜图像中被发现和定位,这将使其更容易获得KIX分子本身的高分辨率图像。
Wakatsuki说,除了看到KIX的结构,他的实验室和Chiu的实验室与Sakamoto和斯坦福大学计算机科学教授Ron Dror合作,能够将其他分子添加到混合中以观察它们是否可能与KIX结合并可能抑制其功能。该团队报告说,他们已经能够使这种结合强度提高约200倍,这可能有助于科学家开发出在较低剂量下有效的药物。
该团队的结果还表明,这种方法可能被证明对其他尺寸介于两者之间的蛋白质有用,这些蛋白质很难用冷冻电镜或X射线晶体学进行研究--也许包括一些病毒蛋白。Wakatsuki说:"我们正在推进扩大该方法的适用性。"
这项研究得到了美国国家研究院的资助。
