癌转移时或有一场能量大爆发…破解癌症致命难题,问问蠕虫怎么说?
其中关键原因就是我们不知道癌细胞究竟是如何突破组织屏障的,由于癌转移基本不可预测,而转移又发生在体内深处,几乎超过了现有技术能观察和追踪的水平。“这似乎有点讽刺,它在癌症中最致命,我们却了解得最少,”美国杜克大学的生物学教授David Sherwood表示。

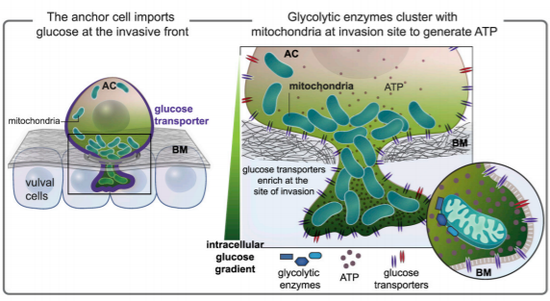
但据《发育细胞》的一项新研究,他和同事找到了一个突破研究障碍的帮手:蠕虫。研究中使用的秀丽隐杆线虫在发育过程中会经历一个特殊的时期,它们的生殖道形成依赖于一种被称作锚细胞的特殊细胞。这类细胞需要突破致密的组织层,然后才能构建出提供交配和产卵的通道。
这一点和癌细胞转移时的情形非常相似,癌细胞在转移时也会在细胞表面形成肉芽状的突起,这些突起会不断挤压组织屏障,最后形成可以供给细胞通过的通道,然后开始实现转移。这其中就有一个非常关键的问题,是什么在供给它们的“突破”行为,如果有办法抑制这一行为,那么癌细胞的转移计划就能被提前终止。
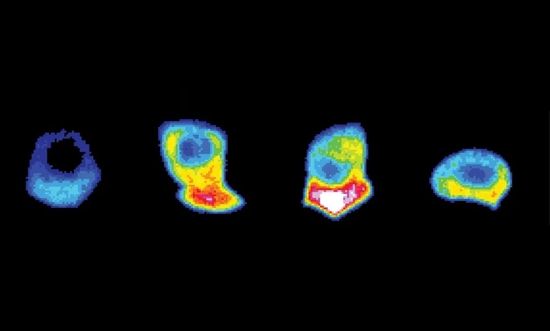
研究者利用特殊的显微镜对线虫细胞进行了延时追踪,主要锁定的是细胞从旁侧组织中挤出的时候发生了什么。由于“突破”行为对细胞来说是一项能量消耗极大的工程,因此研究者考虑的是追踪细胞的ATP水平变化。
这些线虫的细胞经过特殊的基因工程改造后,会表达监测ATP水平的感受器,当ATP分子很多的时候便会发出可供显微镜观测的荧光。结果,在细胞开始突破组织屏障的时候,突破最前端发出了极其亮眼的荧光,研究指出这里似乎产生了ATP的爆发式倾泻。
在神经生长因子(netrin)的信号引导下,大量的线粒体会朝着细胞突破处聚集,这些线粒体生产了不计其数的ATP。为了阻止这种突破行为,研究者设法筛选了8300个线虫基因,他们开始逐个阻止其中的基因表达,然后观察细胞的突破行为。
在一次又一次测试后,当研究者干扰了fgt-1和fgt-2基因时异常发生了,细胞不再能够完成突破行为了。具体来看,这两个基因编码的FGT-1和FGT-2蛋白是一类门蛋白,它们会聚集在细胞的边界,调控着葡萄糖的跨膜运输。
在细胞突破时,大量的葡萄糖会因此而涌入细胞内部,为线粒体制造ATP提供原料。当fgt-1和fgt-2基因失活时,细胞内的葡萄糖和ATP水平都下降了,细胞制造突起的能力也大幅度削弱,至少有1/3的细胞完全停止了突破行为。
“失去葡萄糖,细胞穿越组织的计划会被打破,”Sherwood教授表示,这也预示癌转移时可能也存在同样的弱点,他们推测阻止这种ATP的爆发式产生,或许就能阻止癌细胞转移,这也是他们下一步计划探索的研究方向。
参考资料:
[1] From a tiny worm come new clues to how metastatic cancer cells power their deadly spread。 Retrieved Mar 23th, 2022 from https://medicalxpress.com/news/2022-03-tiny-worm-clues-metastatic-cancer.html
[2] Aastha Garde et al, Localized glucose import, glycolytic processing, and mitochondria generate a focused ATP burst to power basement-membrane invasion, Developmental Cell (2022)。 DOI: 10.1016/j.devcel.2022.02.019
本文来自药明康德内容微信团队,欢迎转发到朋友圈,谢绝转载到其他平台。如有开设白名单需求,请在“学术经纬”公众号主页回复“转载”获取转载须知。其他合作需求,请联系wuxi_media@wuxiapptec.com。
免责声明:药明康德内容团队专注介绍全球生物医药健康研究进展。本文仅作信息交流之目的,文中观点不代表药明康德立场,亦不代表药明康德支持或反对文中观点。本文也不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。
